|
1- ATOMÍSTICA 1.1
Definição de átomo Tudo que ocupa lugar na natureza e tem massa é
matéria, sejam sólidos, líquidos ou gases. Por exemplo, a água é matéria e
está em estado líquido. Dividindo-se consecutivas vezes uma porção de água,
chega-se a uma gota. Continuando-se a divisão, haveria um determinado momento
em que, se fosse dividida novamente, a água deixaria de existir e
apareceriam, separados, os elementos que a compõem. A menor partícula em que se pode dividir um
material sem se alterarem as suas características básicas é chamada de
molécula. As moléculas são constituídas por elementos puros, diferentes ou
não, que se agrupam para formá-las. Esses elementos são chamados de átomos. Pode-se afirmar que o átomo é o elemento
básico de toda a natureza. Se um átomo de hidrogênio, por exemplo, for
dividido, deixará de ser o elemento hidrogênio, ou seja, deixará de existir
como matéria. Então,
átomo é o elemento básico da matéria 1.2
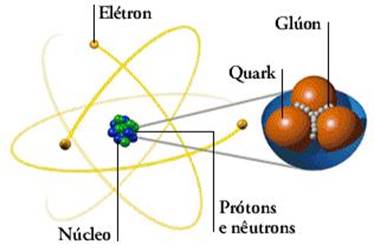
Estrutura do átomo Os
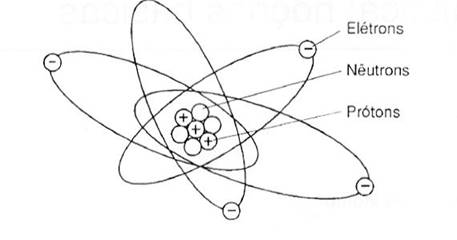
átomos são compostos de duas partes: núcleo e eletrosfera O
núcleo é a parte pesada do átomo e suas partículas não se movimentam. A eletrosfera é a parte externa do átomo e tem
suas partículas sempre movimentando-se em volta do núcleo. As partículas que formam o núcleo são: os
prótons, que têm carga elétrica positiva, e os nêutrons, que não têm carga
elétrica. As partículas que formam a eletrosfera são os
elétrons, que têm carga elétrica negativa. Pode-se
observar a estrutura do átomo através da ilustração a seguir
Fig. 1 – Estrutura do átomo Cada elemento existente na natureza apresenta
átomos diferentes dos demais elementos. Essa diferença está, basicamente, no
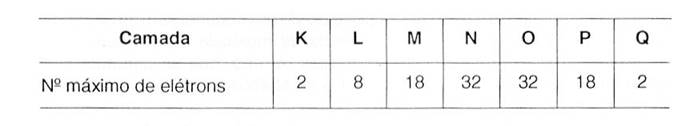
número de prótons, elétrons e nêutrons que formam os seus átomos. Os elétrons têm órbitas definidas na eletrosfera,
obedecendo a um número máximo por camada, conforme a tabela seguinte:
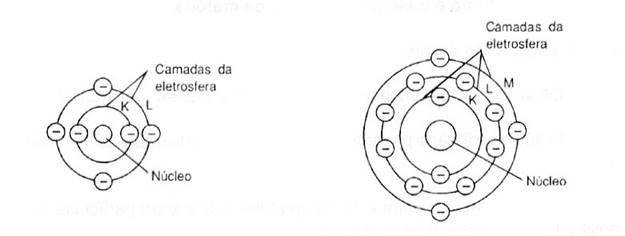
Tab. 1 – Número máximo de elétrons por camada Observa-se, a seguir, a eletrosfera nos átomos
de carbono e de alumínio, respectivamente.
Quanto maior o número de elétrons presentes no
átomo maior o seu número de camadas. Como já foi estudado, os prótons do núcleo têm
cargas elétricas positivas. Os elétrons, por terem cargas elétricas
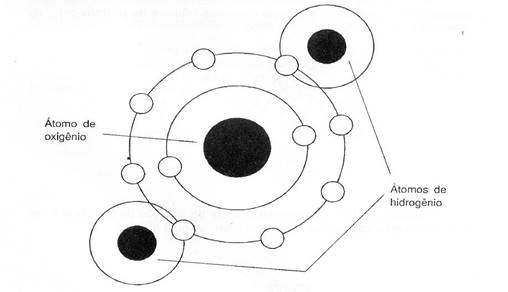
negativas, são atraídos pelo núcleo e permanecem girando ao redor do mesmo. Os elétrons da última camada são fracamente
atraídos pelo núcleo por estarem mais distantes do mesmo,- sendo através
desses elétrons que os átomos combinam-se uns com os outros para formarem as
moléculas que, agrupadas, formam a matéria. A última camada de elétrons é chamada camada
de valência, porque valência é o nome dado à propriedade que os átomos
possuem de se combinarem uns com os outros. Na camada de valência, sempre haverá um número
máximo de oito elétrons, independente de qual seja ela (K, L, M, N, 0, P ou Q
).
Fig. 3 - Molécula Características
das Partículas: Prótons:
tem carga elétrica positiva e uma massa unitária. Nêutrons: não tem carga
elétrica mas tem massa unitária. Elétrons: tem carga elétrica negativa e
quase não possuem massa. Partículas
Fundamentais Os físicos dividem as partículas atômicas
fundamentais em três categorias: quarks, léptons e bósons. Os léptons são
partículas leves como o elétron. Os bósons são partículas sem massa que
propagam todas as forças do Universo. O glúon, por exemplo, é um bóson que
une os quarks e estes formam os prótons e os nêutrons no núcleo atômico. Os quarks se combinam para formar as
partículas pesadas, como o próton e o nêutron. As partículas formadas pelos
quarks são chamadas hádrons. Tal como outras partículas tem cargas
diferentes, tipos diferentes de quarks tem propriedades distintas, chamadas
"sabores" e "cores" , que afetam a forma de como eles se
combinam.
Fig.4 – Partículas fundamentais do átom |